Cuando te tomas una pastilla, el medicamento viaja por todo el cuerpo aunque el problema esté en un punto concreto. A veces funciona, pero otras veces deja efectos secundarios que nadie ha pedido.
Un grupo de investigadores en Suiza propone un atajo: una cápsula diminuta que se conduce con imanes y libera el fármaco justo en el destino. La idea es simple: menos “baño general” y más precisión.
El problema de siempre: el fármaco se reparte donde no hace falta
Muchos tratamientos entran en la sangre y pasan por casi todos los órganos, incluso cuando solo harían falta en una zona. Eso aumenta el riesgo de que actúen fuera de su diana y causen efectos secundarios. La Asociación Estadounidense para el Avance de la Ciencia calcula que esa exposición fuera de objetivo explica cerca de un tercio de los fracasos en ensayos clínicos.
En un ictus, por ejemplo, el coágulo que bloquea un vaso está en un sitio concreto, a menudo en el cerebro. Pero el fármaco para disolverlo circula por todo el cuerpo y, para que llegue suficiente cantidad al tapón, a veces hay que usar dosis altas. Eso puede elevar riesgos como los sangrados.
Por eso existe la llamada entrega dirigida: llevar el medicamento justo a su objetivo, como una llave en su cerradura. Lo difícil es navegar por vasos pequeños, con curvas y con la sangre empujando en contra. Aquí es donde entra el microrrobot.
Así funciona el microrobot: cápsula, control magnético y seguimiento por imagen
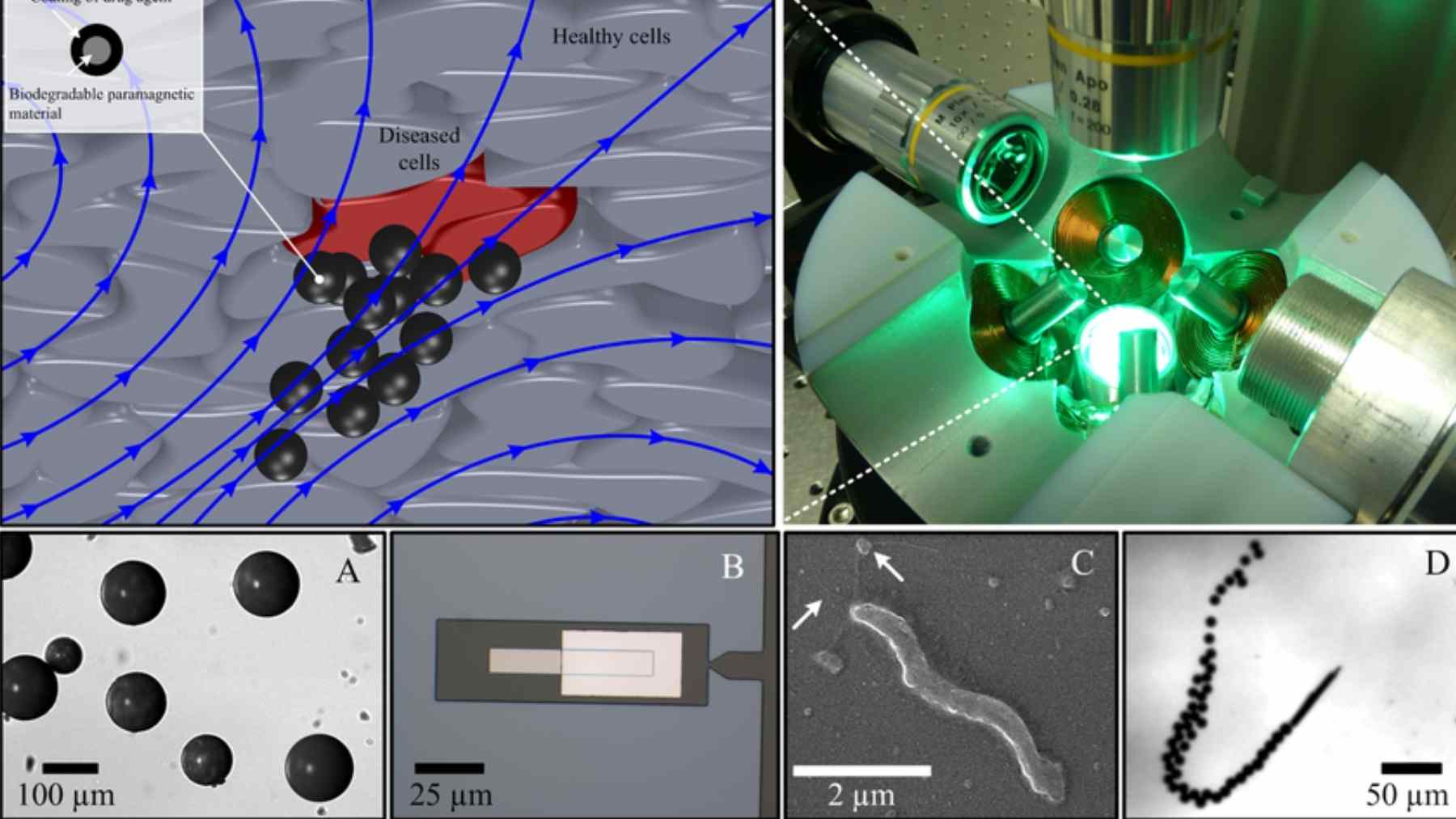
El microrobot no es un robot con patas, sino una esfera minúscula con medicamento dentro, pensada para disolverse y desaparecer tras soltar la dosis. Para controlarlo desde fuera, la cápsula incorpora partículas que responden a campos magnéticos y otras que permiten verla con rayos X. Sin esa “señal” visual, pilotarlo sería ir a ciegas.
La estrategia médica tiene dos pasos: acercar la cápsula con un catéter y luego guiarla con un sistema de navegación electromagnética hasta el punto exacto. El equipo probó la plataforma en modelos de vasos y después en animales grandes, como cerdos y ovejas, y demostró que podía liberar el fármaco en el lugar elegido tras disolver la cápsula. El artículo, con decenas de autores, se publicó el 13 de noviembre de 2025 en la revista Science.
El desarrollo lo lidera el Multi-Scale Robotics Lab de ETH Zúrich, con Fabian Landers como primer autor, junto a Bradley J. Nelson y Salvador Pané, y con apoyo de hospitales y universidades de varios países. En la Universidad de Wurzburgo, la profesora Tessa Lühmann participó en pruebas con tissue plasminogen activator, una enzima usada para disolver coágulos y muy sensible al calor. El equipo buscó el punto justo en el que la cápsula se deshace sin estropear el medicamento.
Qué podría cambiar en hospitales y qué falta por demostrar
Los autores ven usos más allá del ictus, como infecciones localizadas o tumores donde una dosis alta sería demasiado agresiva. Bradley J. Nelson lo resumió con una frase clara: “Estamos solo en la punta del iceberg”, y cree que los cirujanos tendrán muchas ideas para aplicarlo a aneurismas, cánceres cerebrales agresivos y malformaciones arteriovenosas. La promesa es reducir efectos secundarios sin perder eficacia.
Desde fuera también llegan elogios. Howie Choset, profesor de robótica e ingeniería biomédica en la Universidad Carnegie Mellon, dijo que es de lo más emocionante que ha visto en atención de alta precisión. Aun así, el paso decisivo será demostrar seguridad y beneficio en ensayos con personas.
Además, esto encaja con una tendencia más amplia en microrrobótica médica. En junio de 2025, Science Robotics publicó microrrobots para tratar infecciones bacterianas profundas en los senos paranasales, y en diciembre de 2024 apareció otro enfoque con microrrobots de hidrogel guiados por imagen y ultrasonidos que luego se reabsorben. El rumbo está claro: tratamientos más finos y menos “a lo bruto”.
El estudio principal ha sido publicado en Science.